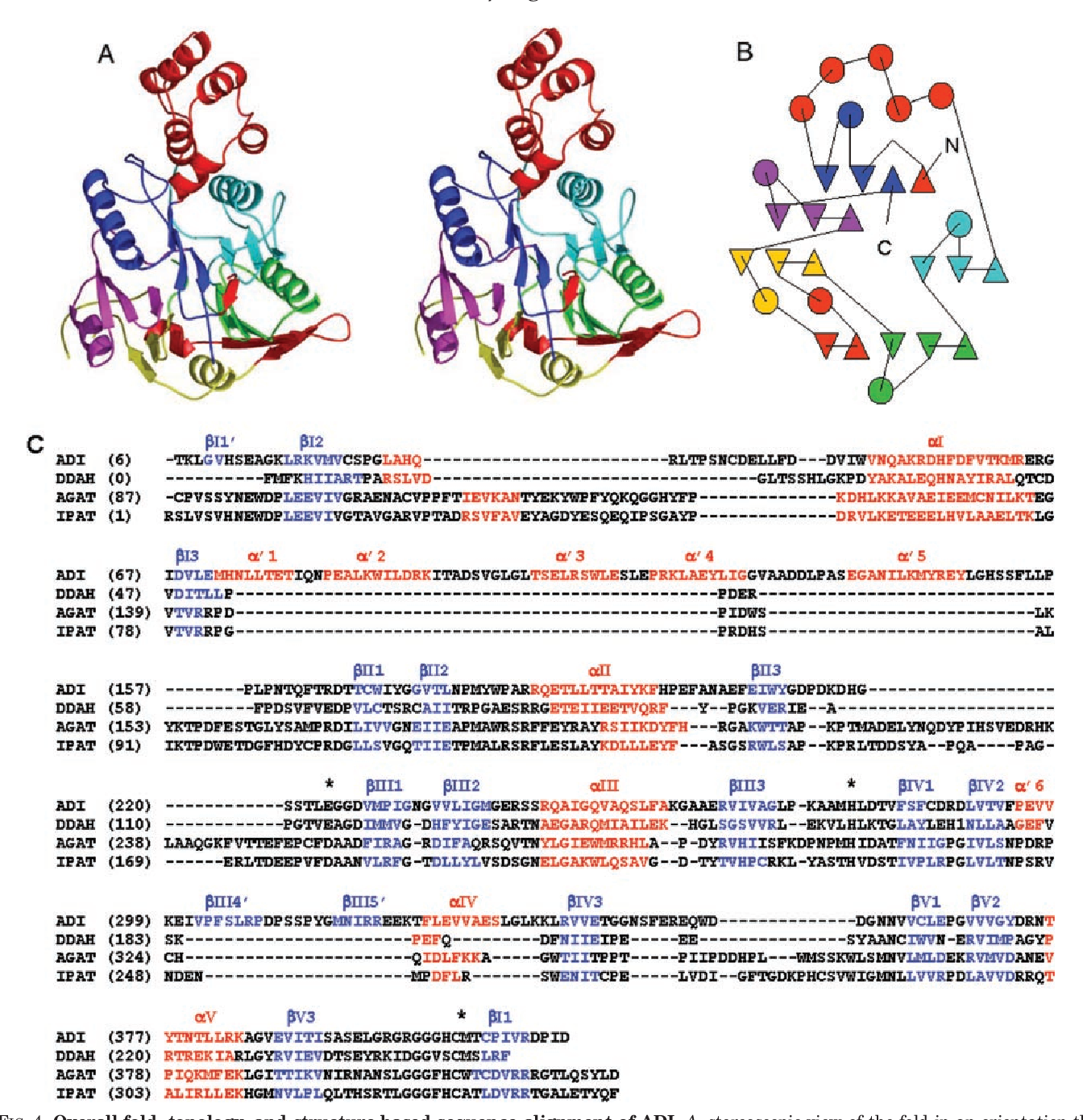
La D-arginine déshydrogénase, ou D-aminoacide déshydrogénase (anciennement EC 1.4.99.1) est une oxydoréductase qui catalyse la réaction :
- D-arginine accepteur H2O 5-guanidino-2-oxopentanoate NH3 accepteur réduit (réaction globale) :
- D-arginine accepteur iminoarginine accepteur réduit
- iminoarginine H2O 5-guanidino-2-oxopentanoate NH3 (spontané).
Cette enzyme possède une très large spécificité par rapport à son substrat : elle agit sur à peu près tous les acides aminés D hormis sur le D-glutamate et le D-aspartate ; elle est inactive sur la glycine, et son activité est maximum sur la D-arginine et la D-lysine. Elle utilise du FAD et du fer non héminique comme cofacteurs.
Cette réaction est distincte de celle catalysée par la D-aminoacide oxydase, qui utilise l'oxygène comme second substrat, tandis que la déshydrogénase peut utiliser différents composés comme accepteurs d'électrons, le substrat physiologique étant une coenzyme Q,.
Notes et références
- Portail de la biochimie